Ульяновская область
Муниципальный этап Всероссийской олимпиады школьников по химии 2010-2011
Инструкция по выполнению заданий
На выполнение 6 заданий олимпиады отводится 4 часа (240 мин). Каждое из 6 заданий включает условие и вопросы. Прежде чем отвечать на вопросы, внимательно прочитайте условия задания. Постарайтесь ответить на все заданные вопросы. Все задания оцениваются примерно одинаковым количеством баллов, но неравноценны по трудности. Начинайте выполнение заданий с самых лёгких, постепенно переходя к более трудным. При выполнении заданий можно пользоваться периодической системой Д.И.Менделеева, таблицей растворимости, электрохимическим рядом напряжений металлов, калькулятором. Желаем успеха!
10 класс
Задание 10-1. ХЛОР.
А) Первым боевым отравляющим веществом были хлор. Германия его применила 22 апреля 1915 г. в долине р. Ипр против французской дивизии. Только в один этот день было отравлено 15 тыс. человек, из которых 5 тыс. погибли.
Б) Согласно ГОСТ 2874-54, после 30-минутного контакта хлора с водой остаточного хлора должно быть не более 0,5 мг/л и не менее 0,3 мг/л при выходе с очистных сооружений, не менее 0,1 мг/л в наиболее отдаленных точках водозабора.
Вопросы:
1) Если бы французы знали химические свойства хлора, как бы они могли бы предотвратить столь масштабные отравления?
2) Предложите альтернативный способ защиты от отравления хлором, с помощью веществ и материалов, имеющихся практически в каждом доме.
3) Почему возможно применение хлора и как боевого отравляющего вещества и с целью обеззараживания воды?
4) Почему происходит снижение концентрации хлора в отдалённых точках водозабора
5) Рассчитайте объём хлора при н.у., который необходимо растворить резервуаре с водой, объёмом 6000 м3 для достижения концентрации хлора 0,5 мг/л.
6) Составьте уравнение химической реакции, протекающей при растворении хлора в воде.
7) Что произойдёт, если раствор, содержащий хлор, подвергнуть облучению светом? Составьте соответствующее уравнение химической реакции.
8) Составьте уравнение реакций хлора с водным раствором гидроксида натрия, протекающей при комнатной температуре.
Задание 10-2. ЗАЩИТА ОКРУЖАЮЩЕЙ СРЕДЫ И НАНОХИМИЯ.
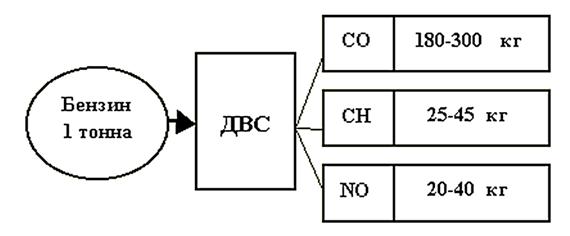
Известно, что значительный ущерб окружающей среде и здоровью человека наносят автомобили. Так в выхлопных газах двигателя внутреннего сгорания (ДВС) были обнаружены угарный газ (СО), циклические ароматические углеводороды (СН), оксид азота (II) (NO) (см. рисунок).
Для уменьшения выбросов вредных веществ в атмосферу в устройствах каталитического окисления выхлопных газов автомобилей может быть применена платина. Платина позволяет превратить оксид углерода (II) в оксид углерода (IV). Особенно эффективно каталитические свойства проявляет платина, находящаяся в виде наночастиц.
Физические свойства многих веществ зависят от размеров образца. Так, температура плавления частиц золота размером 5-10 нм на сотни градусов ниже температуры плавления куска золота объемом 1 см3. Наночастицы вещества часто обладают свойствами, которых вообще нет у образцов этих веществ, имеющих обычные размеры. Известно, например, что золото и серебро не участвуют в большинстве химических реакций. Однако наночастицы серебра или золота не только становятся очень хорошими катализаторами химических реакций (ускоряют их протекание), но и непосредственно участвуют в химических реакциях. На микрофото показана поверхность серебра обычных размеров (слева наверху) и наночастиц серебра (слева внизу). Справа показано увеличенное изображение поверхности наночастицы серебра, сделанное с помощью атомно-силовой микроскопии.
Вопросы:
1) Рассчитайте диапазон масс вредных выбросов, образующихся при сжигании 1 полного бака (40 л) бензина марки А-92 (плотность бензина 0,75 г/см3)
2) Сколько наночастиц состава Pt20 можно получить из 3,5 см3 металла? (плотность платины составляет 21,45 г/см3)
3) Известно, что серебро не вступает в реакцию с соляной кислотой. Однако, образец серебра, состоящий из наночастиц, реагирует с соляной кислотой с выделением водорода. Составьте соответствующее уравнение химической реакции.
4) Активность наночастиц магния настолько велика, что материал, состоящий из таких частиц, соединяется с метаном. Предложите структурную формулу продукта такой химической реакции, если известно, что 1 моль атомарного магния вступает в реакцию с 1 молем метана.
Задание 10-3. СОЕДИНЕНИЯ ГАЛОГЕНОВ.
А) Иногда в магазинах можно встретить йодированную соль. В неё специально добавляют соли содержащие йод (обычно это йодид калия), так как йод очень важный микроэлемент. Что бы доказать содержание в ней йода проведём несложный опыт. Насыплем в стакан чайную ложку соли, зальём её чайной ложкой воды и перемешаем. Затем добавим пол чайной ложки уксуса и столько же раствора пероксида (перекиси) водорода. Через несколько минут насыплем в стакан немного крахмала. Постепенно раствор окрасился в ……………..цвет.
Б) К порошку металла, широко применяемом в авиастроении «А», добавили кристаллическое вещество тёмно-фиолетового цвета «Б». Смесь тщательно перемешали, однако реакции не наблюдалось. К смеси добавили несколько капель воды, и через некоторое время началась бурная реакция. Образовалось вещество «В». В воздух поднялись клубы фиолетового пара.
В) В пластиковую ёмкость насыпали фторид натрия, добавили концентрированной серной кислоты, образовался ядовитый газ «Х». Емкость закрыли пластиковой крышкой, с прикрепленной к внутренней поверхности стеклянной пластиной. Через некоторое время стекло вынули из сосуда, промыли водой и протёрли. Стекло стало матовым.
Вопросы:
1) В какой цвет окрасится раствор?
2) Зачем в реакционную смесь добавляют уксус и крахмал?
3) Составьте уравнение реакции, позволяющей обнаружить йод в поваренной соли.
4) Почему пероксид водорода не реагирует с хлоридом натрия?
5) Назовите вещества «А», «Б», «В»
6) Составьте уравнение реакции получения газа «Х»
7) Составьте соответствующее уравнение химической реакции, объясняющей получение матового стекла.
Задание 10-4. НЕИЗВЕСТНОЕ ВЕЩЕСТВО.
Это удивительное вещество «А» не переносит прямого солнечного света, а некоторые добавки разлагают его так быстро, что оно будто вскипает. Установлено, что «А» всегда образуется во влажной атмосфере при грозовом разряде. Как кровоостанавливающее и дезинфицирующее средство, его чаще всего используют в виде 3% водного раствора, который продается в аптеках;
в медицине применяется также концентрированный 30% раствор (препарат «Б»). Домашние хозяйки с его помощью выводят пятна и отбеливают ткани, а современные модницы обесцвечивают волосы перед покраской. Однако, обращаться с ним надо очень аккуратно: попадая на кожу рук, он вызывает ожоги. Особенно надо беречь глаза. По этой причине для бытовых целей удобнее использовать твердое соединение вещества «А» с мочевиной (ее формула CO(NH2)2), которое также можно купить в аптеке (препарат «В»). Действие раствора, содержащего таблетку «В» массой 1,25 г в стакане воды, будет таким же, как если бы Вы взяли одну столовую ложку (15 г) 3% раствора «А» на стакан воды.
Вопросы:
1) Приведите название вещества «А» и препаратов «Б» и «В».
2) Рассчитайте мольное соотношение «А» и мочевины в препарате «В».
3) Какие вы знаете добавки, ускоряющие разложение «А»
4) На чем основаны дезинфицирующие и отбеливающие свойства «А»? Составьте соответствующее уравнение химической реакции.
5) Почему оно образуется в атмосфере только при грозовом разряде?
Задание 10-5. ПРЕВРАЩЕНИЯ СУЛЬФАТА МЕДИ (II)
В демонстрационную пробирку, наполовину заполненную раствором сульфата меди (II) поместили кусочек лития размером с горошину. На поверхности раствора соли произошла энергичная реакция с выделением газообразного вещества. Выделившийся газ собрали в перевёрнутую вверх дном пробирку и подожгли. Произошёл характерный хлопок. В верхней части пробирки образовалось твердое вещество, черного цвета, которое местами окрасилось в красный цвет. Из раствора выпал осадок голубого цвета.
Вопросы:
1) Составьте уравнения протекающих химических реакций.
2) В какой цвет окрашен безводный сульфат меди (II), а его раствор?
3) Рассчитайте формулу кристаллогидрата сульфата меди, если известно, что массовая доля кристаллизационной воды составляет в нём 36%
Задание 10-6.РАСПОЗНАВАНИЕ РАСТВОРОВ
Вам выданы растворы следующих солей: Na2CO3, BaCl2, MgSO4, AgNO3.
Вопросы:
1) Возможно ли не прибегая к помощи других реагентов, достоверно различить в какой из колб находится раствор каждого из веществ? Решение представьте в виде таблицы.
2) Какого цвета образующиеся осадки?
3) Как можно отличить друг от друга нерастворимые соли серной и угольной кислот
4) Составьте соответствующие уравнения химических реакций.